화학 원소란 무엇입니까?개념, 특성, 지표 및 예
화학 원소가 무엇인지, 그 특성 및 예를 설명합니다. 또한 주기율표와 화합물.

각 화학 원소(예: 금, 은, 구리)에는 이를 구별하는 특성이 있습니다.
화학 원소란 무엇입니까?
화학 원소는 의 각 기본 형태 건. 항상 다음과 같이 표시됩니다. 원자 동일하고 고유한 유형이므로 분해할 수 없습니다. 물질 사용하여 더 간단합니다. 화학 반응.
화학 원소 또는 단순히 원소에 대해 이야기할 때 우리는 성질과 특성에서 다른 원자와 구별되는 특정 유형의 알려진 원자를 말합니다. 속성 근본적인. 이것은 일반적으로 각각에 대해 다른 기호로 표현됩니다.
화학 원소는 원자입니다. 그러나 다음 사항을 이해해야 합니다. 동일한 화학 원소의 일부인 원자는 동일한 수를 갖습니다. 양성자 핵심(원자 번호), 원자 질량이 다르더라도.
원자 번호는 같은, 즉 같은 화학 원소에 속하지만 원자 수가 다른 원자가 있습니다. 중성자, 따라서 질량수(양성자와 중성자의 합)가 다릅니다. 이러한 유형의 원자를 동위원소라고 합니다.
즉, 각 화학 원소는 그것을 구성하는 동위원소의 양이 다릅니다.
예를 들어, 수소 원소에는 세 가지 자연 발생 동위원소가 있습니다: 프로튬(1H), 중수소(2H) 및 삼중수소(3H). 프로튬은 양성자와 전자 (중성자가 없음) 수소의 가장 풍부한 동위원소입니다. 중수소는 핵에 있는 양성자와 중성자, 그리고 이를 공전하는 전자로 구성됩니다. 삼중수소 핵은 1개의 양성자와 2개의 중성자로 구성되어 있으며 방사성 동위원소입니다. 수소 원소의 다른 동위원소도 실험실에서 합성되었습니다.
두 개 이상의 물질 사이에 화학 반응이 일어나면 이들의 화학 원소가 교환되고 결합하여 새로운 원자 결합을 구성하여 새로운 형태의 물질을 형성합니다. 존재하는 모든 것은 동일한 요소의 조합으로 구성됩니다.
참조 : 화학의 발렌시아
주기율표의 화학 원소

주기율표는 화학 원소를 그래픽으로 질서 있게 표현한 것입니다.
이 원소 주기율표 알려진 모든 화학 원소(화학 기호를 통해 표현됨)를 질서 있게 표현하는 방법입니다. 전자적, 화학적 특성에 따라 원자 번호가 가장 낮은 것부터 행과 열을 통해 원자 번호가 가장 높은 것까지 그룹화됩니다.
이 표는 1869년 Dmitri Mendeleev에 의해 첫 번째 버전으로 제시되었습니다. 그 이후로 최신 버전을 얻을 때까지 확장, 업데이트 및 개선되었습니다.
주기율표 요소를 행(마침표라고 함)과 열( 그룹), 따라서 다음과 같은 다양한 범주로 분류된 요소 세트를 형성합니다. 금속 (알칼리성, 알칼리토류, 란타나이드, 악티나이드, 전이 금속 및 기타 금속으로 나뉩니다), 준금속 그리고 비금속 (할로겐으로 나뉘며, 비활성 가스 및 기타 비금속).
주기율표의 IUPAC 버전을 볼 수 있습니다. 여기.
화학 원소의 예

탄소는 인체에서 가장 풍부한 화학 원소 중 하나입니다.
가장 잘 알려진 화학 원소 중 일부는 다음과 같습니다.
수소(H)
탄소 (다)
산소 (O)
질소 (N)
인 (피)
황 (에스)
알루미늄(Al)
철(Fe)
염소(Cl)
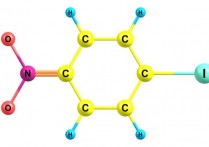
요오드(I)
나트륨 (Na)
칼슘(Ca)
칼륨(K)
수은(Hg)
실버(Ag)
골드 (Au)
구리 (구)
우라늄(U)
아르곤(Ar)
아연(Zn)
헬륨(He)
네온(Ne)
납 (연)
몇 개의 요소가 있습니까?
현재 알려진 원소는 118가지이며 각 원소는 주기율표에 설명되어 있습니다. 그러나 그들 중 일부는 합성, 즉 인공적입니다: 그들은 자연에 존재하지 않고 자연의 실험실에만 존재합니다. 인류.
최신 기술 화학 원소를 통해 최대 129개의 서로 다른 원소를 찾을 수 있습니다, 그 중 다수는 전문 실험실의 매우 특정한 조건에서 단기간 이상 존재하지 않습니다.
화합물
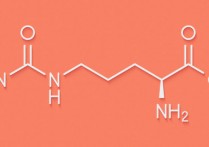
화합물은 서로 다른 화학 원소의 조합에서 발생하는 물질의 형태로 이해됩니다. 이들은 다음과 같은 비교적 간단한 화합물일 수 있습니다. 분자 바이너리(예: 이산화탄소 (CO2)) 또는 다음과 같은 다양한 원자를 가진 복잡한 화합물 고분자 유기적(예: DNA).
진실은 모든 화합물이 적절한 화학 반응이 주어지면 구성 원소로 분해될 수 있는 물질이며, 단원자 또는 기본 물질에 도달할 때까지 점점 더 단순해집니다. 예를 들어 물 (H2O) 전기분해에 의해 가스 형태의 수소와 산소 분자로 분해될 수 있습니다.